
Video: Hvad sker der, når man titrerer en stærk syre med en stærk base?
2024 Forfatter: Stanley Ellington | [email protected]. Sidst ændret: 2023-12-16 00:15
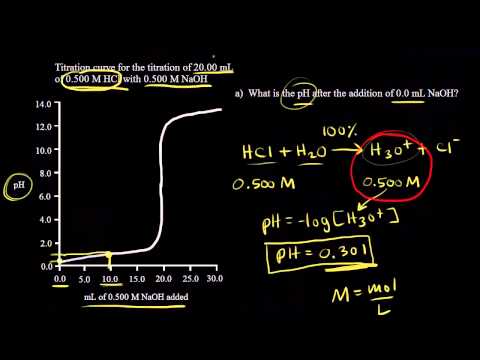
Formålet med en stærk syre - stærk base titrering er at bestemme koncentrationen af den sure opløsning ved titrering det med en grundlæggende opløsning af kendt koncentration, eller omvendt, indtil neutralisering opstår . Derfor er reaktionen mellem en stærk syre og stærk base vil resultere i vand og et salt.
Ligeledes, hvad sker der, når en stærk syre reagerer med en stærk base?
Faktisk, når en stærk syre reagerer med en stærk base De resulterende produkter er vand og et ionsalt. Endnu et eksempel på en sådan reaktion er kemikaliet reaktion mellem saltet syre (HCl) og kaliumhydroxid (KOH).
Ligeledes skal der mere base til for at neutralisere en stærk syre? Stærke syrer vilje neutralisere stærke baser af lige store koncentrationer i lige store mængder. Mere volumen af en svag syre er nødvendig for neutralisere en stærk base hvis koncentrationerne er ens og omvendt for svage baser og stærke syrer . En buffer er en opløsning, der indeholder en svag syre og salt med samme anion som syre.
Hvad sker der i forhold til dette, når du titrerer en svag syre med en stærk base?
I den titrering af en svag syre med en stærk base , konjugatet grundlag af svag syre vil gøre pH ved ækvivalenspunktet større end 7. Derfor du ønsker en indikator til at ændre sig i det pH-område.
Er NaOH en svag base?
Natriumhydroxid ( NaOH ) er stærk grundlag fordi det dissocierer fuldstændigt i vand for at producere hydroxidioner. Mens ammoniak (NH3) er svag base fordi det accepterer protoner fra vand for at producere færre hydroxidioner i opløsning. Mens svage baser producerer færre hydroxidioner, hvilket gør opløsningen mindre basisk.
Anbefalede:
Hvad er stærk og svag syre forklare med eksempel?

Stærke syrer dissocierer (bryder fra hinanden) fuldstændigt i vand). For eksempel HCl, en stærk syre vil bryde op i H+ og Cl-ioner. Svage syrer dissocierer delvist i vand. For eksempel vil HF, en svag syre, kun have nogle af HF -molekylerne dissocieret på et givet tidspunkt
Hvad producerer en svag syre og stærk base?

Saltet af en svag syre og stærk base undergår hydrolyse i vand for at producere yderligere OH-ioner. Da eddikesyre er en svag syre, forbliver den unioniseret i opløsning, og OH-ionerne gør opløsningen basisk eller basisk. På samme måde er et salt af en stærk syre og svag base surt i vandig opløsning
Hvad sker der med ligevægtspris og mængde, når der er en samtidig stigning i efterspørgsel og stigning i udbud?

En stigning i efterspørgslen, alt andet uændret, vil få ligevægtsprisen til at stige; den leverede mængde vil stige. Et fald i efterspørgslen vil få ligevægtsprisen til at falde; den leverede mængde vil falde. Et fald i udbuddet vil få ligevægtsprisen til at stige; den efterspurgte mængde vil falde
Hvad er stærk syre og svag syre med eksempel?

Eksempler på stærke syrer er saltsyre (HCl), perchlorsyre (HClO4), salpetersyre (HNO3) og svovlsyre (H2SO4). En svag syre er kun delvist dissocieret, idet både den udissocierede syre og dens dissociationsprodukter er til stede, i opløsning, i ligevægt med hinanden
Hvorfor var titreringskurvens form forskellig for titreringen af stærk syre vs stærk base og svag syre vs stærk base?

Titreringskurvens generelle form er den samme, men pH ved ækvivalenspunktet er anderledes. Ved en svag syrestærk basetitrering er pH-værdien større end 7 ved ækvivalenspunktet. Ved en stærk syre-svag basetitrering er pH mindre end 7 ved ækvivalenspunktet
